on aquellos compuestos que tienen como función, al grupo carbonilo -CO, y cuya formula general es RCHO.
Se diferencian de las cetonas, de fórmula general RRCO, por:
Los aldehídos se oxidan con facilidad, mientras que las cetonas lo hacen con dificultad.
Los aldehídos son más reactivos en las adiciones nucleofílicas, las que son características de los compuestos carbonílicos.Grupo CarboniloEl carbono está unido a tres átomos mediante enlaces σ . debido a que estos usan orbitales sp2, se mantienen en un plano que los separa entre sí 120º . el orbital p restante, traslapa un p del oxígeno para establecer un enlace ð , por lo que el carbono y el oxígeno quedan unidos mediante un doble enlace.R’
C O
R
120º
Obtenciòn:
La obtención de aldehídos y cetonas se efectúa por oxidación de alcoholes primarios y secundarios, hecha con dicromato potásicoen médio ácido, por hidrólisis del acetileno para obtener un aldehído:HC≡CH+M2O à CH3-COHSO4H2Por hidrólisis de los alqinos, salvo el acetileno, para producir cetonas:CH3-C≡CH+H2O à CH3-CO-CH3Puede realizarse la hidrólisis de los derivados dihalogenados de los hidrocarburos con halógenos en el mismo átomo de carbono para obtener aldehídos o cetonas:CH3-CHCl2+2H2O à 2ClH+CH3-COH+H2OCH3-CCl2-CH3+2H2O à 2ClH+CH3-CO-CH3+H2O
NOMENCLATURA
Los nombres IUPAC siguen un patrón común : la cadena más larga que contiene el grupo – CHO es considerada el esqueleto o matriz y recibe su nombre del reemplazo de la terminación o del alcano por al.
H H H
H – C = O CH3 – C = O C = O
Formaldehído Acetaldehído
Metanal Etanal Benzaldehído
PROPIEDADES FISICAS
El grupo carbonilo lo convierte en una sustancia polar, y por lo tanto tienen punto de ebullición alto en comparación co los compuestos no polares.
No son capaces de unirse por si mismo por medio de puentes de hidrógeno, puesto que solamente contienen hidrógeno unido al carbono.
Los aldehídos inferiores, como era de esperarse, son solubles en el agua, probablemente por el punte de hidrógeno que pueden establecer entre las moléculas de solvente y soluto.
Los usos principales de los aldehídos son:
La fabricación de resinas
Plásticos
Solventes
Pinturas
Perfumes
Esencias











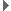 CH3(CH2)5COOH
CH3(CH2)5COOH






